pH, pKa, 濃度の計算方法【化学企業の現場】
こんにちは。
粉体に含まれる酸・塩基性不純物量をどうやって定量しようかってことで1日頭抱えてました。
で、結論、
- 蒸留水に粉体を入れ撹拌し、水溶性成分を抽出
- 抽出液を中和滴定 or pH測定 or 元素分析して酸・塩基成分量を定量化
- 酸塩基成分量/粉体量で濃度を求める
という方法に落ち着きました。
問題:1gの粉体に含まれるフッ化水素の量を求めなさい。
解法1:粉体抽出液のpHからフッ化水素量を求める
1gの粉体を10mLの水で洗浄することでフッ化水素を抽出し、その抽出液のpHからフッ化水素量を算出する方法を考えます。
水の溶解度積、pKa, pH, 電気的中性、酸・塩基成分量の5つの等式からなる連立方程式を解きます。

不明な量は、以下のように調べます。
pKa⇒ネットでデータ探す。フッ化水素のpKa = 3.17
pH⇒pH計やリトマス紙で実測する。今回はpH = 4 だったとしましょう。
これらを上記式に代入し、計算します。
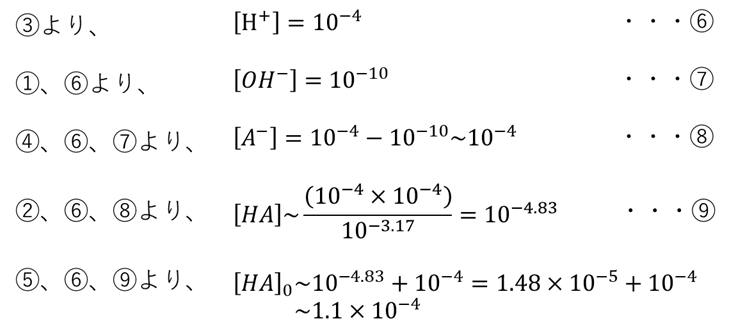
以上より、抽出液中のフッ化水素濃度は約1.1 mol/Lであることが分かりました。
フッ化水素は分子量20なので、
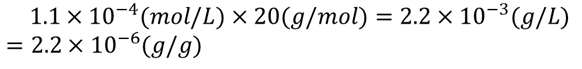
ということで、抽出液のpHが4のとき、フッ化水素濃度は2.2 ppm程度だとわかりました。
すると、10mL (= 10g) の抽出液中には、2.2ppm × 10ml = 22ugのフッ化水素が溶けていることがわかります。
この22ugが粉体1gに含まれていたとすると、22ug/1gで、粉体に含まれるフッ化水素不純物は22ppmと見積もることができます。
↓受験勉強の時にお世話になった本。これ2,3周やっとけば京大くらいは合格圏入るよね。
ちなみに、この値どの程度確からしいのでしょうか?
pH計の誤差は例えば0.01pH±1digitの測定器だと、測定回路由来のもので±0.02程度あるそうです。
例えばpHが3.98と測定された場合、上記抽出液中のフッ化水素濃度は1.21mol/Lと計算され、約5%程度ずれるようです。
それ以外にpH電極の汚染等でもずれます。
解法2:粉体抽出液のフッ素イオン濃度からフッ化水素量を求める
粉体1gから3mlの水でフッ化水素を抽出し、抽出液をイオンクロマトで全フッ素濃度を測定する。
例えば10ppmと検出されれば10ppm × 3ml = 30ugが粉体1gに含まれていることになり、粉体中のフッ化水素濃度は30ppmと見積もることができる。
イオンクロマトの精度ってどんなもんなんでしょうね?
こんな感じで粉体中の酸・塩基不純物濃度の評価ができます。
抽出操作含めて誤差要因はたくさんあるので気を付けましょう。
↓ブログランキング始めました。バナーをクリックしてもらうと順位上がるらしいです。よかったら応援お願いします!

化学ランキング
![]()
にほんブログ村

